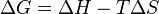Parte 1: Fundamentos de Termodinámica y Termoquímica
La termodinámica estudia los intercambios energéticos en los procesos físicos, químicos o biológicos. La parte que se centra en el estudio del intercambio de energía en las reacciones químicas se denomina termoquímica.
Sistema Termodinámico
Es la parte del universo perfectamente delimitada, sometida a estudio, y el entorno o parte del universo que lo rodea.
Clasificación de Sistemas Termodinámicos
- Sistema abierto: intercambia materia y Sigue leyendo